水は一番生活に身近な液体だけれども、とても不思議な性質を持っている。水は0℃で凍り、100℃で沸騰して気体になる。とはいうけれども、空気中にはいつも水が気体になって存在している。一筋縄ではいかないのだ。
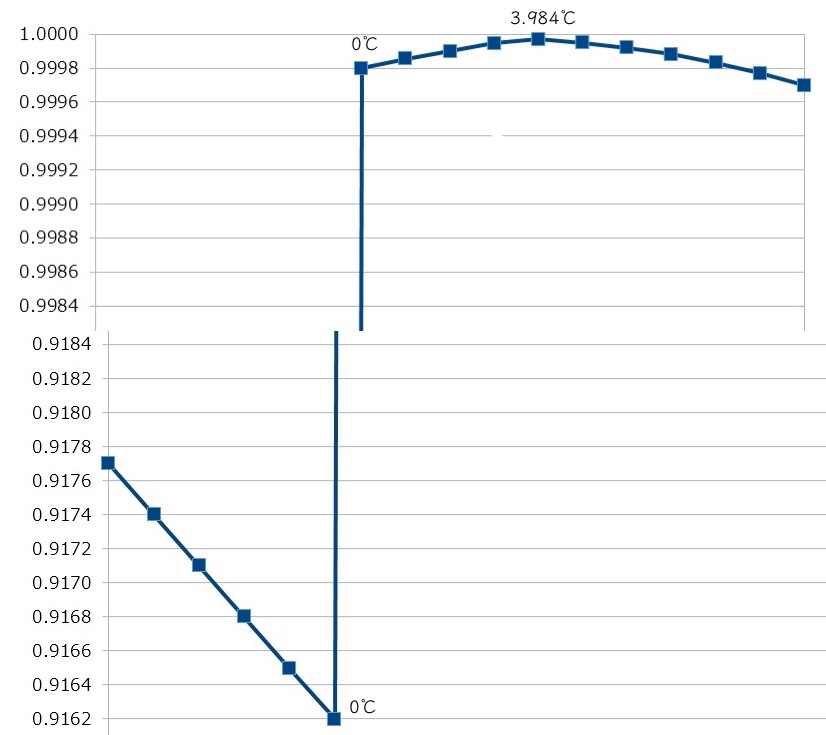
密度が3.984℃で最大
固体、液体、気体の三つの状態があって、加熱すると固体が液体になり、液体が気体になる。液体になる温度が融点で、気体になる温度が沸点である。
中学校の理科では、一般的に物質の体積は「固体<液体<気体」となると教える。密度は逆に「固体>液体>気体」となる。ただし例外が水である。
水は3.984℃のときに最大密度となる。3.984℃の密度は、0.99997495 g/cm3である。3.984℃より温度を上げて行くと密度が下がる(体積が増える)。
不思議なのは、3.984℃より冷やすと密度が低くなるということである。冷やすと密度が下がるという逆転現象だ。
よくこんなデザインのグラフがある。上部の一番高くなっているところが3.984℃の一番密度の高いところである。縦に垂直に変化しているのは、ちょうど融点のあたりで、固体と液体の相互の変化は大変に劇的である。
氷
そして、水が凍って固体になると、つまり氷になると、今度は密度が急に約1割も減少する。0℃の氷の密度は、0.9162g/cm3だ。固体になって密度が減少するのも珍しいことなのだ。
結晶化の際に体積が膨張する。固体になると液体よりも体積が増加する物質は、水の他には「ケイ素」「ゲルマニウム」「ガリウム」「ビスマス」のみとされている。
氷をさらに冷やすと、氷の密度は今度は少しずつ増加する。
-10℃ 0.9189 g/cm3
-20℃ 0.9194 g/cm3
-30℃ 0.9200 g/cm3
-40℃ 0.9208 g/cm3
-50℃ 0.9216 g/cm3
-60℃ 0.9224 g/cm3
外気が氷点下で、湖の表面の水が凍った時、氷は水よりも軽いため湖の表面に浮かぶ。もし、氷が重かったら、氷は湖の底に沈んでいき、表面の水がまた外気に触れて凍ることとなり、湖の水は全部が凍ってしまう。
しかし、実際には、密度の大きい4℃の水が底に沈んでいき、湖の表面では氷が守っていて、急激に全ての水が凍ることはない。湖底には4℃の水が沈んで、湖の魚も水が凍らない間は生きていることができる。
なお、先ほどのグラフは真ん中で切ってあって、実際の縮尺ではかなり感覚が異なるので、参考までに掲載する。縦線は本来垂直に引くべきであるが少し斜めになってしまっている。
水は気圧が低いと100℃未満で沸騰する
高い山に登った方は経験があるかもしれないが、気圧が低いところでは、お湯を沸かしても100℃よりもずっと低い温度で沸騰してしまう。標高が3000mのところでは、気圧はおよそ700hPaくらいとなり、90℃で沸騰する。
逆に気圧の高い環境を人工的に作って、水を加熱すると、100℃より高い温度で沸騰する。圧力鍋の中では、煮物も100℃より高い温度になっているはずである。
これは全く別の話であるが、お湯に塩を溶かし入れると、沸点が少し上がるというのも人間の知恵である。そば・うどんに少し塩を練りこんでおいたり、パスタを茹でるときに塩を入れるのも味だけではない、調理の効果があるのである。
0℃以下でも水蒸気は存在する
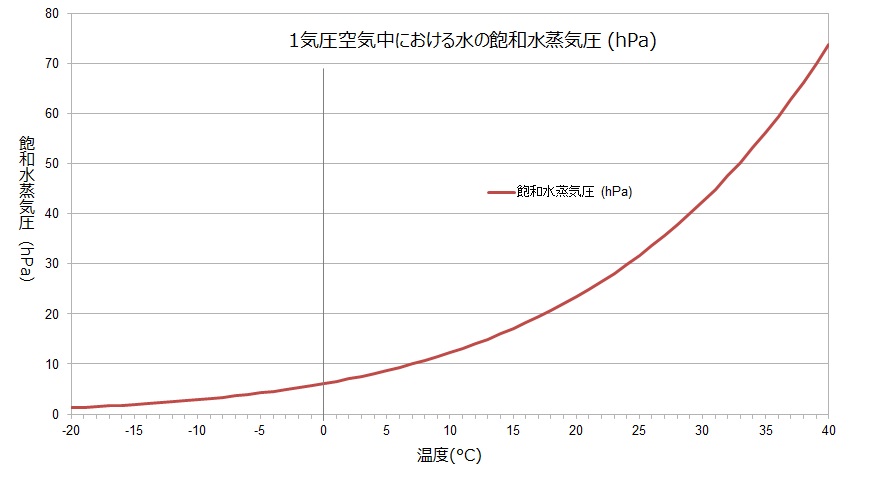
以前に湿度のページで書いたのだが、水蒸気は気温が0℃以下になってもゼロにはならない。湿度は0%にはならないのである。
上のグラフは、空気中に存在することのできる水蒸気の量を示している。
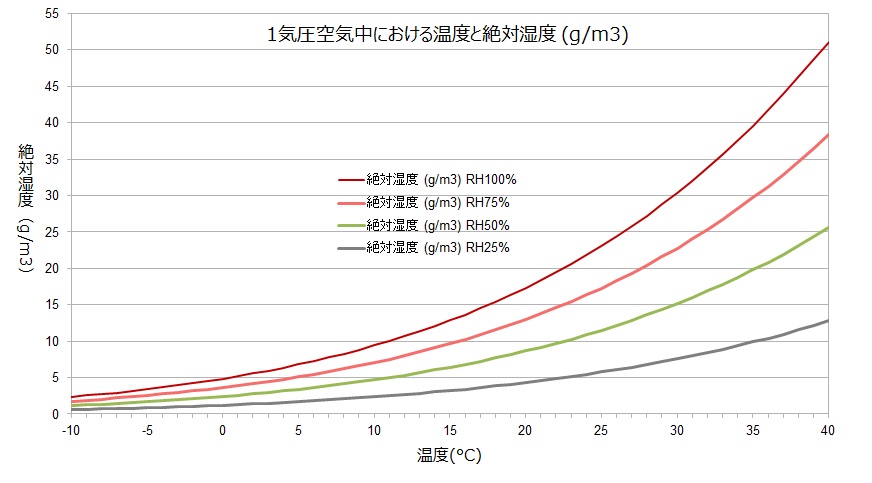
そして次のグラフは、相対湿度がそれぞれ100%、75%、50%、25%の時の絶対湿度を示している。分かりやすく言えば、水分量のことである。
100℃の熱い氷がある
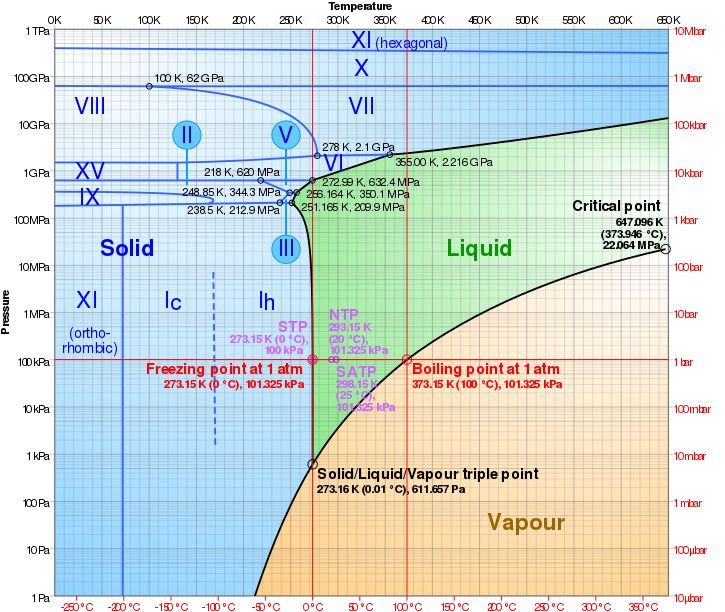
次の図は水の状態図で、横軸が温度で縦軸が圧力である。Solidは固体、Liquidは液体、Vapourは気体である。
温度と圧力の関係からは、水は様々な形態を取りうることが分かる。水は、10万気圧では温度が100℃でも固体で存在することができるということである。
このグラフの真ん中の下の方にある、0.01℃で611.657Paのポイントには、Solid/Liquid/Vapour triple pointと書いてある。ここでは、水は固体と液体と気体のどの形態もあり得るという。三相が共存して、安定した状態で存在する。水の三重点という。
また、100℃以下でも気圧を下げていくと水分はどんどんと気体になっていく。この原理を応用したものはフリーズドライである。食品を凍らせて、そのまま気圧を下げて水分だけを蒸発させるのだ。
超臨界流体
水の状態図では、右側の液体と気体の境目に、Critical Pointというのがある。これが水の臨界点で、これ以上の温度・圧力をかけた時に、気体と液体との区別がつかない状態になる。それを超臨界流体(Super Ciritical Fruid)という。
この状態の超臨界流体の水(超臨界水とも言う)は酸化力が非常に高く、通常は腐食しにくいとされる金や白金・イリジウム合金なども腐食させることができる。つまり危険な強酸を使わずに化学的な処理ができる。
| 溶媒 | 分子量
g/mol |
臨界温度
K |
臨界圧力
MPa (atm) |
密度
g/cm3 |
|---|---|---|---|---|
| 水 | 18.02 | 647.3 | 22.12 (218.3) | 0.348 |
| 二酸化炭素 | 44.01 | 304.1 | 7.38 (72.8) | 0.469 |
二酸化炭素の超臨界流体は304.1 K、摂氏にして31℃と低いので、分子を破壊しないで特定の成分の抽出などができるため、コーヒーの脱カフェインにも応用されている。
用語説明:
・比重: 3.984℃の最も密度の高い水の質量を基準にした、物質の質量の比率。単位はない。
・密度: 質量 ÷ 体積 で求められる。→ つまり、単位体積あたりの質量。密度は一般に温度が上がるにつれて密度は次第に小さくなる。温度が上がるほど分子間が離れて体積が増えるために密度が小さくなる。水は例外である。
・ケルビン: 絶対温度の単位。K という表記をする。0℃は273.15 K。[°C] = [K] − 273.15 で換算できる。
関連記事:
・「相対湿度から絶対湿度への計算方法」
・「酸性・アルカリ性・中性とは何?pHや水素イオン指数・液性・温泉」
・「エタノール水溶液の度数と密度から水分体積%・アルコール質量・比重を計算する」
・カテゴリー「身体・物質・自然科学」