酸性やアルカリ性を示す単位がpH(ピーエイチ、ペーハーと発音する人もいる)であり、液性とも言う。
pHとは、水素イオン濃度を示す単位で、7が真ん中の中性で、数値が7より小さくなると酸性が強くなり、7より大きくなるとアルカリ性が強くなることを示す。
酸性、アルカリ性、中性とは何か?
酸性とかアルカリ性というのは、さまざまな水溶液の特性をあらわすために使われる。
液性と言って、液体の性質であるから、本来は固体には酸性とかアルカリ性というものはないが、水溶液となった時にアルカリ性となる物質をアルカリ性の物質という場合もある。水に溶ける物質は、水溶液になった時点で、何らかの液性を示す。
液性は、石鹸や洗剤、食品など、いろいろな液体について測定されている。温泉でもいろいろな含有成分とともに液性が必ず表示されている。
酸性・アルカリ性・中性の特徴
酸性というのは、塩酸とか胃液とか、ものを溶かしたり消化したりする動植物には強い反応を及ぼす液体である。金属を溶かすことが多い。硫酸のような強酸性の液体は大変に危険な劇薬である。
アルカリ性の物質を飲んだり触ったりすることがないので、説明しにくいが石鹸水やアンモニア水や漂白剤などがアルカリ性である。たんぱく質を溶かすことが多い。強アルカリ性の液体も人体に害を及ぼす劇薬である。
中性の代表的なものは純水である。水道水も一定の範囲で中性となるよう調整されている。中性の液体は、酸性やアルカリ性の性質を示さない。
また、強い酸性の液体と強いアルカリ性の物質や液体を混ぜると、爆発的な反応をすることがあり危険である。
酸性・アルカリ性を示す単位はpH
酸性からアルカリ性に対して1から14の数値を対応させて、酸性とアルカリ性の度合いを示したものがpHという単位である。
pHの読み方は、「ピーエイチ」という。以前には、ドイツ語風に「ペーハー」と発音することが多かった。(読み方については後述)
酸性とアルカリ性というのは、互いに反する特性である。酸性が弱まってくると中性になる。アルカリ性が弱まると中性になる。
その酸性とアルカリ性のちょうど中間が、中性であり、pHは7としている。7より小さくなっていくと酸性になり、7より大きくなっていくとアルカリ性になる。
(より正確に言うと、25℃の純水はpH=7であり、温度が変わるとpH値は変化する。純水は温度が変化しても中性である。温度が変わるとpH値は変化するのである。詳細は後で説明する。)
身近な液体のpH
身近な液体のpHの目安を以下に示す。
pH 1 胃液
pH 2 レモン果汁
pH 3 お酢
pH 4
pH 5 コーヒーのブラック
pH 6 雨水(通常の雨)
pH 7 純水
pH 8 海水
pH 9
pH 10 石鹸水
pH 11
pH 12 石灰水、コンクリート
pH 13 塩素系漂白剤、カビ取り剤
pH 14 アルカリ乾電池の電解液
pH7が中性で刺激がない状態である。酸性、アルカリ性、どちらに傾いても、程度が強くなれば、人にとっては刺激が強くなり危険度が増す。
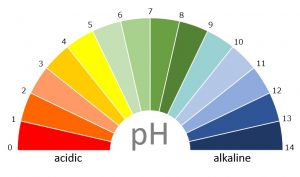
酸性・アルカリ性・中性の見分け方
中学校では、3つの方法を習う。実験も行うことが多い。
- リトマス紙:青色が赤くなると酸性。赤色が青くなるとアルカリ性。
- BTB溶液:黄色が酸性。緑が中性。青がアルカリ性。
- フェノールフタレイン溶液:赤くなるとアルカリ性
アルコール(エタノール)の液性は?
エタノールは、直感的には酸性のようにも思えるが、実は中性である。もちろん水で割っても中性である。体内に入ると酸性になる。というのは、次のように反応するからだ。「エタノール→アセトアルデヒド→酢酸」
飲み物としてのお酒の場合は、他の含有物によって液性が変わってくるが、ほとんど酸性である。ワインはpH3〜4くらいの酸性で、ビール・日本酒がpH4〜4.5くらい、焼酎・ウィスキーがpH5くらいだ。エタノールが中性なので、アルコール濃度が高くなるほど中性pH7に近づいていく。
酸性、アルカリ性の物質はどのようなものか?
呼称や化学式から、酸性かアルカリ性かを完全に見分ける公式はない。
原理からいえば、酸性というのは水に溶けた時に、H+イオンを生じる物質であり、アルカリ性というのは、OH–イオンを生じる物質である。全体でどちらがどれだけ多いかで液性が決まる。
塩酸は、HCl → H+ + Cl- となるので、酸性である。一方、水酸化ナトリウムは、NaOH → Na+ + OH– となり、アルカリ性である。
酸性の例:
塩酸:HCl
硫酸:H2SO4
硝酸:HNO3
炭酸:H2CO3
酢酸:C2H402
炭酸を除くと強酸で、塩酸、硫酸、硝酸は劇薬である。
炭酸というのは、水に二酸化炭素が溶けているので、化合してH2CO3 となる。水と共に存在する炭酸は安定せず、どんどんと水と二酸化炭素に分離していく。
水溶液中では、 H2CO3 → 2H+ + HCO3 というイオンになって存在する。H+イオンがあるから、酸性に傾くわけであるが、何らかの刺激により、二酸化炭素がジュワーっと出る時は、H2CO3 → H2O + CO2 という反応が起こっているのである。
アルカリ性の例:
水酸化ナトリウム:NaOH
水酸化カルシウム:Ca(OH)2
水酸化カリウム:KOH
アンモニア水:NH4OH
水とイオン
水は化学式で H2O である。水素原子が2個と酸素原子が1個が結合している。学校で「水は電気を通さないが、塩水にすると電気が通る」という実験をやった人もいるかもしれない。
純水は中性である。H+イオンとOH–イオンの量が同じ時に中性となる。
純水はほとんど電気を通さないが、それはイオンが少ないからで、電気を通す物質はイオンが多いということがある。(塩水の中では Na+、Cl–というイオンが濃度に応じた導電性をもたらすのである)
このイオンが多いほど電気を通すのであって、塩素や様々なものが混ざっている水道水よりも、不純物のない純水ほど電気を通さないのである。
純水や超純水においても、水分子のごく一部が電離して水素イオンH+と水酸化物イオンOH−が存在するため、電気抵抗は無限大にはならないということである。
イオンを表現するときに、右肩に小さなプラスやマイナスをつけているのは、電子を与えたり、もらったりすることで、電気的に変化したことを意味しているからで、イオンについて言う時には必ず電気的な特性があるということだ。
水素イオン濃度と水酸化物イオン濃度の関係は?
それぞれのモル濃度を水素イオン濃度[H+]、水酸化物イオン濃度[OH−]と表現する。これは指数ではなく、実際の濃度のことだ。
25°Cの純水では中性なので、水素イオン濃度[H+]と水酸化物イオン濃度[OH−]は等しくなる。そして、[H+] = [OH−] = 1×10−7 mol/L となる。
純水に酸を加えると[H+]が増えて[OH−]が減り、酸性になる。また、純水に塩基(アルカリ)を加えると[OH−]が増えて[H+]が減り、アルカリ性になる。このように[H+]と[OH−]の関係は、 一方が増えればもう一方が減る関係にある。
「温度が一定ならば、水素イオン濃度と水酸化物イオン濃度の積は一定の値になる」という関係がある。
25°Cにおける、 [H+] × [OH−] = 1×10−14 (mol/L)
純水に酸を加えて、[H+]が10倍になったとき、[OH−]は減って1/10になるということだ。この関係は水溶液全般についてあてはまる。条件は温度が25℃だということだ。
水溶液が25℃のとき、水素イオン濃度[H+] = 1×10−3 mol/L であったならば、水酸化物イオン濃度[OH–] = 1×10−11 mol/L となる。
[H+]と[OH−]のどちらか一方が増えればもう一方が減る関係を使うことで、特定の温度の時の[H+]の量が分かれば、水溶液の酸性・中性・アルカリ性を表すことができる。
つまり、
酸性:[H+] > 10−7 mol/L → [H+]が[OH−]よりも多い
中性:[H+] = 10−7 mol/L → [H+]と[OH−]が等しい
アルカリ性:[H+] < 10−7 mol/L → [H+]は[OH−]よりも少ない
ということだ。
pHの意味は?
[H+] が 10-7 mol/L よりどれだけ多いのか、どれだけ少ないかを考える。
例えば、
中性だと 10-7 であれば、10-7 = 0.0000001 となり、
強アルカリ性で 10-12 であれば、10-12 = 0.000000000001 となる。
強酸性で 10-2 であれば 10-2 = 0.01 である。
0.0000001と0.000000000001と0.01を比べても人間には扱いにくいし、何よりも間違えやすい。もっと細かくなって、0.0000000013と0.0000000024などとなるとどちらが大きいのか分かりにくく大変に不便である。
そこで、10-7とか10-5などのように、水素イオン濃度の指数の右肩の数字からマイナスの符号を外した値をpHとした。こういうのを対数表現という。
[H+] = 10−n mol/L の時には、水素イオン指数 pH = n
酸性:pH < 7
中性:pH = 7
アルカリ性:pH > 7
ここで同様に水酸化物イオン濃度を [OH–] = 10−n mol/L の時には、
水酸化物イオン指数 pOH = n となる。
そして、pH + pOH = 14 が成り立つ。
( [H+] × [OH−] = 1×10−14 (mol/L) と同じことである )
pHの温度変化による変化
ここまでは温度が25℃であった場合について書いたきた。
水は温度が上がると、pHが下がる。温度が高いほど、H+とOH–に分かれてイオンになりやすい。分子がイオンに分かれることを解離という。
そして、他の物質の影響を受けずに解離することを自己解離という。温度が上がるとより自己解離する。
H2OがH+とOH–に分かれてイオンになっても、それぞれのイオンの数は同数なので、中性のまま変わらない。にもかかわらず、[H+]の数は増えるので、pHに換算すると数値が下がるのである。
ど真ん中の中性であるままに、pH値が下がる。ということは、つまり、
同じ液体であっても温度によって、中性のpHが異なる
ということなのである。pHが温度によって変化することをpHの温度依存という。
次の表は、純水の中性の時のpH値を温度ごとに示した表である。
純水のpH値(温度依存)
| 温度(℃) | pH |
| 0℃ | 7.47 |
| 10℃ | 7.27 |
| 20℃ | 7.08 |
| 25℃ | 7.00 |
| 30℃ | 6.92 |
| 40℃ | 6.77 |
| 50℃ | 6.63 |
| 60℃ | 6.51 |
ということは、実は「中性はpH=7」というのは厳密には正しくないということになる。
40℃の時の、中性はpH6.77である。40℃でpH=7であったら、わずかにアルカリ性になっているということだ。
25℃の純水はpH=7であるが、この水を40℃まで加熱するとpH=6.77になるということである。元の純水が中性であったように、40℃の純水も中性である。ただpHの値が変わる。
このように、温度変化で水溶液の性質(液性)が変わるわけではないので、測定の時の温度を考慮しなければいけないということだ。通常、温度を25度で安定するよう恒温槽に寝かしてから測定するとのことである。
酸性・アルカリ性・中性に関する基準値について
家庭用品品質表示法における漂白剤・合成洗剤・石けんなどの液性は次のようになっている。
| 液性 | pHの範囲 |
|---|---|
| 酸性 | pH < 3.0 |
| 弱酸性 | 3.0 ≦ pH < 6.0 |
| 中性 | 6.0 ≦ pH ≦ 8.0 |
| 弱アルカリ性 | 8.0 < pH ≦ 11.0 |
| アルカリ性 | 11.0 < pH |
pH=7 を中心として両側に対称になっている。
温泉のpHはどうなのか?
一方、温泉では少し数値が異なり、湧き出した時のpH値により次の通りに分類される。中性を真ん中に対称にはなっていない。
| 泉質 | pH |
| 酸性 | pH < 3 |
| 弱酸性 | 3 ≦ pH < 6 |
| 中性 | 6 ≦ pH < 7.5 |
| 弱アルカリ性 | 7.5 ≦ pH < 8.5 |
| アルカリ性 | 8.5 ≦ pH |
先ほどの液性の温度イオンのために、中性をずらしているわけではない。
環境省自然環境局「鉱泉分析法指針(平成26年改定)」では、「6. 物理および物理化学試験、6-2 pHの測定」の項(p.25)に、源泉における試料の採取については、「200〜500mLのポリエチレンびんに上部に空間を残さないように採取、密栓したのち急冷(または加温)して25℃とする」と書かれている。やはり、温泉も25℃で測定するので、温泉の中性の中央値を7.0としていないのは温度のせいではないということになる。
弱酸性の幅をpH値で3としているが、弱アルカリ性ではpH値の幅で1しか余裕をもたせていない。これは、アルカリ泉が少ないこともあるだろうが、もっと重要なことは、アルカリ性は肌の感覚では感じ取りにくく、肌を痛めるリスクが高いことを考慮したためであろうと推察する。
イオンの活量について
温泉水には様々なイオンが多量に溶けている。ミネラルも多量に存在する。イオンの量をそれ単体で計測することが難しいので、イオンの濃度ではなくて、活量を扱うことが多い。
化学的にはイオンの濃度よりも活量が重要になってくる。活量とは、化学表現で言い換えると「熱力学的に有効な濃度」である。現代のIUPACやJISでもこの活量を基礎として水素イオン指数が定義されている。
実際の溶液中では、イオンの能力は分子間力で打ち消されて100%働くことはない。理想的な状態を実際の状態に近づけるための係数が活量係数である。
活量係数(f) × 濃度= 活量
この活量係数(f)は、計器では測定できないので、計算や実験によって推測することになる。
pH = – log(aH)
aH:水素イオンの活量
aH = f * [H+] ここでfは活量係数である
とすると、これはpHの定義そのものである。現在のIUPACやJISで採用されているのも、この活量を用いた定義となっている。
食品や人体の酸性とアルカリ性
食品の酸性、アルカリ性については、化学でいう酸性・アルカリ性という液性とは全く考え方が違う。
食品を燃やして灰にしたものを水溶液にして計測する方法を19世紀後半にスイスの生理学者グスタフ・フォン・ブンゲが示したものが始まりだ。しかし、現代の医学界では健康との関連性については疑問視されている。
アルカリ性のものは食べられるものはほとんどない。石鹸水や石灰水、コンクリート、漂白剤、アルカリ乾電池などである。では、なぜアルカリ性食品などというのだろうか。それは上述の方法によるものだ。
人体では、胃液が酸性で、腸ではアルカリ性の液を分泌する。皮膚表面は弱酸性という。人体の機能は複雑で奥が深い。「食品や人体の酸性とアルカリ性について」
pHをなぜペーハーと発音するのか?
pHをペーハーと発音することに慣れている人も多いだろう。これは一般には、ドイツ語読みが広まったからだと言われている。ところが、少し不思議なことがある。
pHは、何の略かというと、wikipediaではpotential of hydrogenとなっている。また他にも、power of hydrogen ion concentrationとか、これが合わさったようなpower potential of hydrogenという言葉がある。
はて? これらはすべて英語である。どうやっても「ペーハー」と発音する根拠がない。ドイツ語では、Wasserstoffionenexponentという。複合語を分解すると、Wasserstoffが水素、ionenがイオンの複数形、exponentが指数だ。ドイツ語では水素の頭文字はHではない。
pHの概念は、1909年にデンマークの化学者セーレン・セーレンセン(Søren Peter Lauritz Sørensen)がデンマークのカールスバーグ研究所で最初に導入した。カールスバーグ研究所によればpHはpower of hydrogenという。
そしてpHのpの意味については、「力」を表すドイツ語のpotenzやフランス語のpuissanceであることが示唆されている。また、ラテン語では、pondus hydrogeniiが水素の量、potentiala hydrogeniiが水素の力にも由来するという。
ちなみに、当時セーレンセンが提案した表記方法は、PHだった。PがメインでHが下付きの添字になっていた。今とは逆だった。
つまり、pHとドイツ語は本来関係がなく、医学や化学がドイツから入ってきた時に、これらの専門用語と混ざり合ったまま、日本の医療・化学関係者が、英語の略号もドイツ語読みをしたことが慣例となって、そのドイツ語読みのまま定着したようだ。
その他:酸性・アルカリ性に関わる雑学的な話題
- 純水は、空気に触れるとCO2が溶け込むので、少し酸性に変化する。
- 雨は、降ってくる途中で空気中の二酸化炭素が雨粒に溶けていき、水に溶ける最大量の二酸化炭素を含んだとすると雨のpHは5.6になるという。だからpHが5.6までは酸性雨とは言わない。実際には雨は通常ではpH6.0くらいである。
- 海水は、溶け込んでいるミネラル類等によってアルカリ性である。しかし、近年は、大気のCO2が増加した結果、海水もその影響を受けて、少し酸性よりに(中性の方向に)近づいている。海水の酸性化というのは、アルカリ性が中性に向かっているということである。
- 気象庁のデータでは、1985年に日本近海の北緯30度でpH8.15だったが、2015年には8.10になった。海水の酸性化は少しずつ確実に進んでいる。
関連記事
・「フランスのナチュラル・ミネラルウォーターの硬度(Ca, Mg 等)と採水地・pH」
・「エタノール水溶液の度数と密度から水分体積%・アルコール質量・比重を計算する」
関連するカテゴリー:
・身体・物質・自然科学

